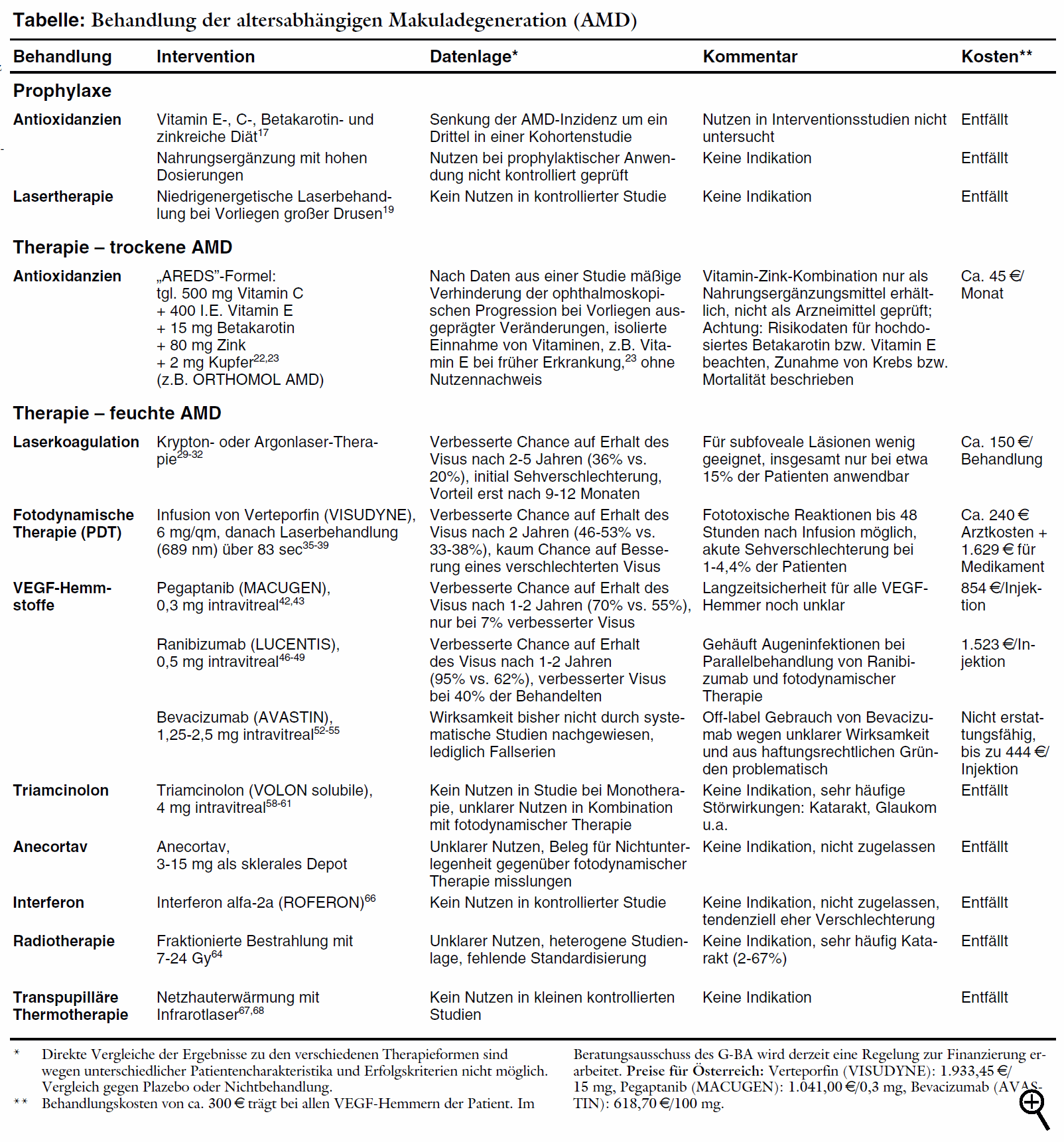
THERAPIE DER ALTERSABHÄNGIGEN
MAKULADEGENERATION (II) |
In a-t 2007; 38: 3-4 und 13-14 stellten wir Krankheitsbild und Diagnostik der altersabhängigen
Makuladegeneration (AMD) sowie die Therapie der trockenen Verlaufsform dar. Im Folgenden beschreiben wir Therapiemöglichkeiten der feuchten
Verlaufsform. Der in den Studien gewählte Endpunkt Sehverschlechterung wird definiert als Verlust von mindestens 3 Zeilen (6 Zeilen bei Lasertherapie) auf der
EDTRS-Sehtafel. Weitere Definitionen und Erläuterungen siehe Kasten in a-t 2007; 38: 4.
 Laserkoagulation: Die Zerstörung pathologischer
Gefäßneubildungen durch Argon- oder Kryptonlaser war die erste wirksame Behandlung der feuchten Makuladegeneration. In mehreren Studien wurde bei
Patienten mit extrafovealer,29 juxtafovealer30 oder subfovealer31 Lokalisation der Einfluss der Laserbehandlung auf Sehschärfe und
Lesevermögen geprüft. Die Patienten litten bei Studienbeginn unter mäßigen bis erheblichen Sehbeeinträchtigungen. Bei bis zu
fünfjähriger Nachbeobachtung verringert die Lasertherapie die Rate der Patienten mit sich verschlechterndem Visus (extrafoveal: 48% vs. 62%29,
subfoveal: 22% vs. 47%31).* Die geringe Nachbeobachtungsrate von zum Teil unter 70% schränkt die Validität der Studien jedoch ein. Laserkoagulation: Die Zerstörung pathologischer
Gefäßneubildungen durch Argon- oder Kryptonlaser war die erste wirksame Behandlung der feuchten Makuladegeneration. In mehreren Studien wurde bei
Patienten mit extrafovealer,29 juxtafovealer30 oder subfovealer31 Lokalisation der Einfluss der Laserbehandlung auf Sehschärfe und
Lesevermögen geprüft. Die Patienten litten bei Studienbeginn unter mäßigen bis erheblichen Sehbeeinträchtigungen. Bei bis zu
fünfjähriger Nachbeobachtung verringert die Lasertherapie die Rate der Patienten mit sich verschlechterndem Visus (extrafoveal: 48% vs. 62%29,
subfoveal: 22% vs. 47%31).* Die geringe Nachbeobachtungsrate von zum Teil unter 70% schränkt die Validität der Studien jedoch ein.
Im zeitlichen Zusammenhang mit der Lasertherapie vermindert sich zunächst der Visus akut spürbar aufgrund der mit Skotomen einhergehenden
Gewebedestruktion. Dies ist besonders bei nahe an der Fovea liegenden (subfovealen) Läsionen wegen der Gefahr erheblicher Sehbeeinträchtigung
problematisch. Erst nach neun bis zwölf Monaten beginnen die Behandelten aufgrund der gegenüber Nichtbehandlung langsameren Progression zu
profitieren. Bei nahezu jedem Zweiten ist allerdings innerhalb von drei Jahren nach Behandlungsbeginn mit einer unmittelbar fortschreitenden oder rezidivierenden
Neovaskularisation zu rechnen.32 Nach aktuellen Einschätzungen eignen sich nur 10% bis 15% aller neovaskulären Schäden für eine
Laserbehandlung.4 Der Großteil der Patienten mit altersabhängiger Makuladegeneration hat zu nah an der Fovea gelegene bzw. okkulte oder
aufgrund von subretinalen Einblutungen unscharf demarkierte Netzhautschäden, die meist ungeeignet für eine Laserbehandlung sind. So beschränkt
sich trotz positiver Studienergebnisse auch bei subfovealem Befall31 die Lasertherapie in der Praxis auf gut abgrenzbare klassische extrafoveale
Neovaskularisationen.
 Fotodynamische Therapie: Bei der fotodynamischen Therapie werden
zunächst lichtreaktive Substanzen intravenös infundiert. Anschließend wird durch Laserlicht mit definierter Wellenlänge die Entstehung hoch
reaktiven Singulett-Sauerstoffs im belichteten Bereich gefördert. Reaktiver Sauerstoff induziert eine lokale Schädigung des Gefäßendothels mit
Gefäßverschluss in den belichteten Gebieten, vorzugsweise in pathologischen Gefäßneubildungen. Die verwendeten Lichtquellen sind stark
genug, die fotoreaktive Substanz zu aktivieren, sollen jedoch selber das Gewebe nicht schädigen. Fotodynamische Therapie: Bei der fotodynamischen Therapie werden
zunächst lichtreaktive Substanzen intravenös infundiert. Anschließend wird durch Laserlicht mit definierter Wellenlänge die Entstehung hoch
reaktiven Singulett-Sauerstoffs im belichteten Bereich gefördert. Reaktiver Sauerstoff induziert eine lokale Schädigung des Gefäßendothels mit
Gefäßverschluss in den belichteten Gebieten, vorzugsweise in pathologischen Gefäßneubildungen. Die verwendeten Lichtquellen sind stark
genug, die fotoreaktive Substanz zu aktivieren, sollen jedoch selber das Gewebe nicht schädigen.
Einziger in Europa zugelassener "Fotosensitizer" ist Verteporfin (VISUDYNE; a-t 2000; 31: 84
-5). Er wird für die klassische und die okkulte choroidale Neovaskularisation (CNV) angeboten.33 Bei okkulter CNV muss jedoch ein neu aufgetretener
oder sich verschlechternder Befund nachgewiesen sein. Nach Vorgaben des Gemeinsamen Bundesausschusses wird zudem in Anlehnung an die Studienlage bei
okkulter CNV ein Visus von mindestens 0,2 und eine Läsionsgröße von maximal 5.400 µm gefordert.34
Wirksamkeitsdaten stammen aus zwei Studienprojekten. In der (in zwei Teilstudien durchgeführten) TAP*-Studie erhalten 609 Patienten mit subfovealer
vorwiegend "klassischer" Gefäßneubildung und einem Visus zwischen 0,1 und 0,5 nach Lokalisation mittels Fluoreszein-Angiographie
eine intravenöse Infusion mit Verteporfin (6 mg/m2 Körperoberfläche über 10 Minuten) oder Plazebo. Die Läsionen werden dann 83
Sekunden lang mit einem Laser (Wellenlänge 689 nm) bestrahlt. Die Behandlung kann je nach Verlauf alle drei Monate wiederholt werden. Nach einem Jahr
und durchschnittlich 3,4 Behandlungen pro Patient bleiben 61,2% der mit Verteporfin und 46,4% mit Plazebo behandelten Patienten ohne Verschlechterung des
Visus.35 Dieser Erfolg hat nach zwei Jahren Bestand (53% vs. 38%; Number needed to treat [NNT] = 7).36
Unklar ist der Nutzen bei "minimal klassischer" Gefäßneubildung. In der TAP-Studie hat die Subgruppe der Patienten mit diesen
Gefäßveränderungen keinen Vorteil von der Behandlung. In der kleinen plazebokontrollierten VIM**-Studie mit 117 Patienten mit minimal klassischen
Veränderungen und einem Visus von mindestens 0,1 wird nur für die in einem zusätzlichen Arm geprüfte niederenergetische fotodynamische
Therapie (300 mW/cm2 statt der üblichen 600 mW/cm2) ein Nutzen im Vergleich zu Plazebo errechnet.37 Allerdings ist die Studie anfangs ohne
formale statistische Auswertung angelegt, diese wird erst nach Verlängerung der Nachbeobachtung im Rahmen einer Protokolländerung eingeführt.
Die Aussagekraft ist daher begrenzt.
** |
VIM = Visudyne in Minimally Classic Choroidal Neovascularization Study
|
339 Patienten mit okkulten Gefäßneubildungen (Visus mindestens 0,2) erhalten in der VIP***-Studie entweder Verteporfin oder Plazebo mit
nachfolgender üblicher Laserbehandlung. Während nach einem Jahr kein Erfolg nachweisbar ist, verhindert Verteporfin nach zwei Jahren signifikant
häufiger eine Verschlechterung der Sehschärfe (46% vs. 33%; NNT = 8).38 Die Wirksamkeit scheint demnach bei okkulter und klassischer
Gefäßneubildung nach zwei Jahren vergleichbar zu sein und von klinischer Relevanz. Die Auswirkungen auf die Alltagsfähigkeiten der Patienten und
die Lebensqualität bleiben jedoch unklar. Daten zur Mortalität fehlen. Offene Nachbeobachtungen sind publiziert und sollen den fortbestehenden Nutzen
belegen.39,40 Sie sind jedoch aufgrund der zunehmend selektierten Population und fehlender Kontrollen ohne Aussagekraft.
Aufgrund der möglichen Fotosensibilitätsreaktionen (2%) sollen nach Behandlung zwei Tage lang Sonnenlicht und helles Kunstlicht gemieden und eine
Sonnenbrille getragen werden. Treten bei der Infusion Extravasate auf, muss die Hautläsion fünf Tage lang vor Licht geschützt werden. Mit der
Behandlung assoziierte akute schwere, zum Teil bleibende Verschlechterungen der Sehschärfe treten bei 1% bis 4,4% der Behandelten auf,35-38
möglicherweise aufgrund eines intraokulären Anstiegs des endothelialen Wachstumsfaktors VEGF. Auch wenn der Einfluss der Therapie auf
Sehverschlechterungen in der Gesamtauswertung positiv ist, müssen Patienten auf die Möglichkeit solcher akuten Ereignisse hingewiesen werden.
Nach Daten aus einer Beobachtungsstudie lassen sich die Erfolge aus den mit Verteporfin durchgeführten Untersuchungen nur bei Beachtung der
Einschlusskriterien und des Studienprotokolls reproduzieren. Abweichende Indikationsstellung und ungenügende Nachkontrollen zur Planung der weiteren
Behandlung führen zu einem Verlauf, der dem unbehandelter Patienten entspricht.41
 VEGF-Hemmstoffe: Vaskuläre endotheliale Wachstumsfaktoren
(VEGF) sind an der Regulation von Gefäßneubildungen und der Gefäßdurchlässigkeit beteiligt und spielen offenbar eine Rolle in der
Pathogenese der AMD. Der erste für die Indikation zugelassene VEGF-Hemmstoff ist das Oligonukleotid ("Aptamer") VEGF-Hemmstoffe: Vaskuläre endotheliale Wachstumsfaktoren
(VEGF) sind an der Regulation von Gefäßneubildungen und der Gefäßdurchlässigkeit beteiligt und spielen offenbar eine Rolle in der
Pathogenese der AMD. Der erste für die Indikation zugelassene VEGF-Hemmstoff ist das Oligonukleotid ("Aptamer")  Pegaptanib (MACUGEN). Es bindet spezifisch an den VEGF-A-Subtyp 165 und blockiert dadurch seine
Funktion. In zwei identisch angelegten gemeinsam publizierten Studien mit insgesamt 1.186 Patienten mit fortgeschrittener feuchter Makuladegeneration wird
der Einfluss auf den Erhalt des Visus überprüft.42 Die Patienten leiden an subfovealer AMD mit mäßiger bis schwerer
Sehbeeinträchtigung. Sie erhalten randomisiert entweder 0,3 mg (zugelassene Dosierung), 1 mg oder 3 mg Pegaptanib in den Glaskörper (intravitreal) oder
eine Scheininjektion nach identischer Vorbereitungsprozedur. Die Behandlung wird alle sechs Wochen wiederholt. Eine fotodynamische Therapie darf nach
Ermessen der Behandler und gemäß jeweils geltender Standards in beiden Gruppen zusätzlich durchgeführt werden. Pegaptanib (MACUGEN). Es bindet spezifisch an den VEGF-A-Subtyp 165 und blockiert dadurch seine
Funktion. In zwei identisch angelegten gemeinsam publizierten Studien mit insgesamt 1.186 Patienten mit fortgeschrittener feuchter Makuladegeneration wird
der Einfluss auf den Erhalt des Visus überprüft.42 Die Patienten leiden an subfovealer AMD mit mäßiger bis schwerer
Sehbeeinträchtigung. Sie erhalten randomisiert entweder 0,3 mg (zugelassene Dosierung), 1 mg oder 3 mg Pegaptanib in den Glaskörper (intravitreal) oder
eine Scheininjektion nach identischer Vorbereitungsprozedur. Die Behandlung wird alle sechs Wochen wiederholt. Eine fotodynamische Therapie darf nach
Ermessen der Behandler und gemäß jeweils geltender Standards in beiden Gruppen zusätzlich durchgeführt werden.
Nach einem Jahr wird unter 0,3 mg Pegaptanib bei 70% eine Visusverschlechterung verhindert gegenüber 55% unter Scheininjektion (NNT = 7). Weniger
Patienten sind nach einem Jahr erblindet gemäß Studiendefinition (Visus unter 0,2: 38% vs. 56%). Eine relevante Visusverbesserung mit mehr als 15
Buchstaben Gewinn auf der Sehtafel erreichen jedoch nur wenig mehr Patienten unter Verum (6% vs. 2%). Die Wirksamkeit der drei Pegaptanibdosierungen ist
vergleichbar.
Störwirkungen sind vor allem durch die Injektion bedingt. Häufig kommt es zu Schmerzen (34% vs. 28%) und Glaskörpertrübungen (33%
vs. 8%) sowie Entzündungen der vorderen Augenkammer (14% vs. 6%). Endophthalmitis tritt bei 1,3% der Patienten auf. Verletzung der Linse ist bei 0,6%,
Ablösung der Retina bei 0,7% der Patienten beschrieben.
Die notwendige Dauer der Behandlung ist unklar. Absetzen nach einem Jahr führt im Vergleich zur Behandlung über weitere zwölf Monate zu
erneuter Progression.43
Für den bereits seit Längerem in der Schweiz44 und den USA erhältlichen monoklonalen VEGF-Antikörper  Ranibizumab (LUCENTIS) ist die Markteinführung in Deutschland für Mitte
Februar 2007 vorgesehen.45 Im Gegensatz zu Pegaptanib blockiert Ranibizumab alle VEGF-A-Isoformen. Drei zulassungsrelevante Studien, von
denen zwei veröffentlicht sind,46,47 prüfen den Antikörper bei Patienten mit subfovealer Makuladegeneration und mäßiger bis
weit fortgeschrittener Sehbeeinträchtigung. Durch intravitreale Injektionen von 0,3 mg oder 0,5 mg (zugelassene Dosierung) Ranibizumab alle vier Wochen
bleibt bei 95% der Patienten (zwei Drittel mit minimal klassischen, ein Drittel mit okkulte Läsionen) in einem Jahr eine relevante Verschlechterung der Sehleistung
aus versus 62,2% unter Scheininjektion (NNT = 3).46 Auch der Anteil der Patienten mit Visusverbesserung (mindestens 15 Buchstaben bzw. 3 Zeilen) ist
unter 0,5 mg Ranibizumab größer: 33,8% versus 5% unter Plazebo. Patienten unter Verum können nach einem Jahr im Mittel sechs bis sieben
Buchstaben mehr auf der Sehtafel erkennen als zu Beginn der Studie.46 Die Vorteile bleiben bei Weiterbehandlung über ein zweites Jahr erhalten.46 Ranibizumab (LUCENTIS) ist die Markteinführung in Deutschland für Mitte
Februar 2007 vorgesehen.45 Im Gegensatz zu Pegaptanib blockiert Ranibizumab alle VEGF-A-Isoformen. Drei zulassungsrelevante Studien, von
denen zwei veröffentlicht sind,46,47 prüfen den Antikörper bei Patienten mit subfovealer Makuladegeneration und mäßiger bis
weit fortgeschrittener Sehbeeinträchtigung. Durch intravitreale Injektionen von 0,3 mg oder 0,5 mg (zugelassene Dosierung) Ranibizumab alle vier Wochen
bleibt bei 95% der Patienten (zwei Drittel mit minimal klassischen, ein Drittel mit okkulte Läsionen) in einem Jahr eine relevante Verschlechterung der Sehleistung
aus versus 62,2% unter Scheininjektion (NNT = 3).46 Auch der Anteil der Patienten mit Visusverbesserung (mindestens 15 Buchstaben bzw. 3 Zeilen) ist
unter 0,5 mg Ranibizumab größer: 33,8% versus 5% unter Plazebo. Patienten unter Verum können nach einem Jahr im Mittel sechs bis sieben
Buchstaben mehr auf der Sehtafel erkennen als zu Beginn der Studie.46 Die Vorteile bleiben bei Weiterbehandlung über ein zweites Jahr erhalten.46
Ähnlich sind die Ergebnisse beim direkten Vergleich mit fotodynamischer Therapie bei klassischen Läsionen.47 423 Patienten werden mit
Ranibizumab (0,3 mg oder 0,5 mg) oder mit Verteporfin als Fotosensitizer behandelt. Der Visus bleibt bei 96% unter Ranibizumab gegenüber 64% unter
Verteporfin erhalten (NNT = 3). Eine Visusverbesserung erreichen 40% unter 0,5 mg Ranibizumab vs. 6% unter Verteporfin.
Bei Verlängerung der Injektionsabstände auf drei Monate nimmt nach Daten aus einer dritten Studie möglicherweise die Wirksamkeit ab. Nach
anfänglich verbesserter Sehschärfe unter monatlichen Behandlungen verschlechtert sich diese bei Fortführung der Therapie mit größeren
Dosierungsintervallen wieder.48,49
Schwere Störwirkungen sind injektionsbedingte Entzündungen des Auges (Endophthalmitis, ca. 1%) und Uveitis (0,7%). In einem Brief an
amerikanische Augenärzte warnt der Hersteller aufgrund von Daten aus einer noch laufenden Sicherheitsstudie mit 5.000 Patienten jetzt vor einem
erhöhten Schlaganfallrisiko unter der zugelassenen Dosis von 0,5 mg Ranibizumab (1,2% vs. 0,3% unter 0,3 mg; p = 0,02).70 Ein weiteres Risikosignal
für nichtokuläre Störwirkungen ist die erhöhte Blutungsrate sowohl im Vergleich zu Scheininjektion (8,8% vs. 5,5%) als auch gegenüber
Verteporfin (6,4% vs. 2,1%).46,47 In der 0,5 mg-Gruppe entwickeln nach zwei Jahren 6,3% der Patienten Antikörper gegen Ranibizumab, deren
Bedeutung unklar ist. Nach Subgruppenauswertungen besteht kein sicherer Zusammenhang zwischen Antikörperentwicklung und Therapieerfolg oder
Störwirkungen. Allerdings erkranken einige Patienten mit hohen Antikörpertitern an Augenentzündungen.48
Die kombinierte Behandlung von Ranibizumab mit fotodynamischer Therapie erscheint problematisch: In einer kontrollierten Studie mit 162 Patienten bleibt der
Visus unter der Kombination zwar häufiger erhalten als bei alleiniger fotodynamischer Behandlung (90,5% versus 67,9%). Die Kombination führt jedoch
unerwartet häufig zu Augenentzündungen (11,4%) und Verdacht auf Endophthalmitis (4,8%). Ob die Verlängerung der Abstände zwischen
fotodynamischer Therapie und Injektion von Ranibizumab das Entzündungsrisiko senkt, konnte trotz Umstellung des Protokolls in der laufenden Studie nicht
ermittelt werden.50
Unklar ist die Langzeitsicherheit aller VEGF-Hemmstoffe: Die blockierten Wachstumsfaktoren besitzen neben Einflüssen auf Gefäßwachstum
und -durchlässigkeit zusätzliche neuroprotektive Eigenschaften. Eine dauerhafte Blockade kann nach tierexperimentellen Daten zur Entwicklung einer
retinalen Atrophie beitragen.51
Die Einführung von Ranibizumab in Deutschland hat für die Versichertengemeinschaft möglicherweise schwere finanzielle Konsequenzen.
Eine Injektionsflasche wird 1.523 € kosten. Bei monatlicher Anwendung bedeutet dies pro Patient und Jahr Kosten von rund 18.276 €.
Für die Patienten ist von Relevanz, dass sie derzeit generell die Kosten für die intravitreale Injektion zu tragen haben (300 € pro Eingriff), da eine
entsprechende Abrechnungsziffer auch bei Anwendung zugelassener Arzneimittel fehlt.
 Off-label-Gebrauch von Off-label-Gebrauch von  Bevacizumab (AVASTIN): Nicht zuletzt die immensen Kosten für Ranibizumab veranlassen viele Augenärzte, den
hierzulande als Darmkrebsmedikament zugelassenen VEGF-Hemmstoff Bevacizumab (AVASTIN): Nicht zuletzt die immensen Kosten für Ranibizumab veranlassen viele Augenärzte, den
hierzulande als Darmkrebsmedikament zugelassenen VEGF-Hemmstoff  Bevacizumab (AVASTIN) "off label" zur intravitrealen Injektion zu verwenden. Bevacizumab ist die Muttersubstanz von
Ranibizumab, das ein Fragment des Bevacizumab ist. Beide haben denselben Wirkmechanismus, das kleinere Ranibizumab soll aber die Netzhaut besser
durchdringen. Dem günstigeren Preis für Bevacizumab, den der Patient selbst entrichten muss (bis 444 € für das Medikament; die
benötigte Dosis wird aus den zur Krebsbehandlung vorgesehenen Injektionsflaschen entnommen, plus 300 € für den Eingriff), stehen jedoch
erhebliche Wissenslücken entgegen: Fallserien52-55 deuten zwar einen möglichen therapeutischen Effekt an. Kontrollierte Studie fehlen jedoch,
sodass bisher weder Nutzen noch Störwirkungen der intravitrealen Injektion systematisch erfasst sind. Prospektive Daten über mehr als drei Monate
fehlen. Weder optimale Dosierung (angewendet werden 1,25 mg oder 2,5 mg pro Injektion) noch Dosierungsintervalle sind geklärt. Aufgrund der höheren
Molekülgröße sind Unterschiede zu Ranibizumab zu erwarten. Bevacizumab (AVASTIN) "off label" zur intravitrealen Injektion zu verwenden. Bevacizumab ist die Muttersubstanz von
Ranibizumab, das ein Fragment des Bevacizumab ist. Beide haben denselben Wirkmechanismus, das kleinere Ranibizumab soll aber die Netzhaut besser
durchdringen. Dem günstigeren Preis für Bevacizumab, den der Patient selbst entrichten muss (bis 444 € für das Medikament; die
benötigte Dosis wird aus den zur Krebsbehandlung vorgesehenen Injektionsflaschen entnommen, plus 300 € für den Eingriff), stehen jedoch
erhebliche Wissenslücken entgegen: Fallserien52-55 deuten zwar einen möglichen therapeutischen Effekt an. Kontrollierte Studie fehlen jedoch,
sodass bisher weder Nutzen noch Störwirkungen der intravitrealen Injektion systematisch erfasst sind. Prospektive Daten über mehr als drei Monate
fehlen. Weder optimale Dosierung (angewendet werden 1,25 mg oder 2,5 mg pro Injektion) noch Dosierungsintervalle sind geklärt. Aufgrund der höheren
Molekülgröße sind Unterschiede zu Ranibizumab zu erwarten.
Haftungsrechtlich ist die Off-label-Anwendung im Rahmen dieser "individuellen Heilversuche" problematisch. Die Patienten müssen unbedingt
besonders umfassend über alle möglichen, auch seltenen Risiken aufgeklärt werden. Dabei wird in der Rechtsprechung ein deutlich
strengeres Maß als bei zugelassenen länger bekannten Arzneimitteln angelegt: Aufgrund des geringen Kenntnisstandes müssen Patienten auch
über die Möglichkeit bislang unbekannter, unerwarteter Störwirkungen informiert werden.56
Eine Vergleichsstudie mit Bevacizumab und Ranibizumab ist von den US-amerikanischen National Institutes of Health geplant, da der Hersteller Genentech, der die
Lizenz für beide Wirkstoffe hält, kein Interesse an einer systematischen Überprüfung hat.57
 Maßnahmen mit fehlendem oder unklarem Nutzen:
Glukokortikoide wirken nicht nur antientzündlich, sondern können auch das Gefäßwachstum hemmen. Nach
Experteneinschätzung wird in den USA bei der Hälfte der Behandlungen mit fotodynamischer Therapie gleichzeitig ein Kortikoid wie Triamcinolon (VOLON
solubile) intravitreal injiziert, obgleich keine Zulassung hierfür vorliegt.2 Das Kortikoid soll die nach fotodynamischer Therapie ansteigende Produktion
von VEGF hemmen. In einer kleinen randomisierten Studie mit 61 Patienten kann nur bei einem Teil der Visusmessungen ein Vorteil für die kombinierte
Behandlung errechnet werden. Es kommt unter dem Steroid jedoch sehr häufig zu Katarakt (32%) und Erhöhung des Augeninnendrucks (26%).58 Maßnahmen mit fehlendem oder unklarem Nutzen:
Glukokortikoide wirken nicht nur antientzündlich, sondern können auch das Gefäßwachstum hemmen. Nach
Experteneinschätzung wird in den USA bei der Hälfte der Behandlungen mit fotodynamischer Therapie gleichzeitig ein Kortikoid wie Triamcinolon (VOLON
solubile) intravitreal injiziert, obgleich keine Zulassung hierfür vorliegt.2 Das Kortikoid soll die nach fotodynamischer Therapie ansteigende Produktion
von VEGF hemmen. In einer kleinen randomisierten Studie mit 61 Patienten kann nur bei einem Teil der Visusmessungen ein Vorteil für die kombinierte
Behandlung errechnet werden. Es kommt unter dem Steroid jedoch sehr häufig zu Katarakt (32%) und Erhöhung des Augeninnendrucks (26%).58
Der nach unkontrollierten Daten59 vermutete Nutzen einer Monotherapie mit Kortikoiden auf den Verlauf einer altersabhängigen
Makuladegeneration wird in einer randomisierten kontrollierten Studie mit 151 Patienten nicht bestätigt.60,61 Ein Jahr nach einmaliger intravitrealer
Injektion von 4 mg Triamcinolon oder Plazebo kommt es in beiden Gruppen in gleichem Ausmaß zu einer Verschlechterung (Triamcinolon 26%, Plazebo 29%)
auf der Sehtafel. Es häufen sich jedoch auch hier Katarakte unter dem Steroid: Bei 29% der mindestens ein Jahr nachbeobachteten Patienten unter
Triamcinolon ist eine Katarakt-Operation notwendig, unter Plazebo nur bei 5%. Triamcinolon-Injektionen steigern den intraokkulären Druck und machen bei 28%
der Behandelten eine drucksenkende Therapie erforderlich (1,3% unter Plazebo).61
Der Kortisolabkömmling Anecortav soll, subskleral als Depot injiziert, ausgeprägt antiangiogenetisch wirken, ohne typische
Steroidnebenwirkungen oder antiinflammatorische Eigenschaften zu besitzen.62 Wegen unzureichender Nutzenbelege hat die europäische
Arzneimittelbehörde ein negatives Votum angekündigt, der Zulassungsantrag für Anecortav wurde mittlerweile zurückgezogen.63
Radiotherapie soll ebenfalls Gefäßneubildungen verhindern. Die Autoren einer Cochrane-Übersicht halten nach Auswertung von elf
kontrollierten Studien eine mäßige Verlangsamung der Sehverschlechterung zwar für möglich. Eine Bewertung ist jedoch aufgrund der
Heterogenität und fehlenden Standardisierung nicht möglich.64 Hauptrisiko ist die Katarakt, die bei 2% bis 67% der Behandelten
auftritt.65
Auch für Interferone wird eine antiangiogenetische Wirksamkeit angenommen. In einer randomisierten Studie war jedoch der Anteil der Patienten mit
Verlust von mindestens drei Linien auf der Sehtafel unter drei unterschiedlichen Interferon alfa-2a (ROFERON)-Regimen nach einem Jahr numerisch höher als
unter Plazebo (43% bis 54% vs. 38%).66
Bei der transpupillären Thermotherapie wird mit Hilfe eines niederenergetischen Infrarotlasers bei okkulter Gefäßneubildung eine
Erwärmung der Netzhaut herbeigeführt, die die Gefäße verschließen soll. In kleinen randomisierten kontrollierten Studien mit lediglich
2567 bzw. 2868 Patienten lässt sich jedoch kein Vorteil gegenüber Scheinbehandlung feststellen. Eine 2005 auf einem Kongress
vorgestellte kontrollierte Studie,69 nach der die Subgruppe der Patienten mit einem Visus unter 0,2 mit einer Visusverbesserung profitieren soll, ist bislang
nicht veröffentlicht.
 Die bislang eingeführten Behandlungsmethoden der feuchten
Makuladegeneration, einschließlich Laserkoagulation, fotodynamischer Therapie mit Verteporfin (VISUDYNE) sowie dem ersten VEGF-Hemmer (Pegaptanib
(MACUGEN), erhöhen die Chance auf Erhalt des Sehvermögens. Verbesserung des Visus ist nicht zu erwarten. Die bislang eingeführten Behandlungsmethoden der feuchten
Makuladegeneration, einschließlich Laserkoagulation, fotodynamischer Therapie mit Verteporfin (VISUDYNE) sowie dem ersten VEGF-Hemmer (Pegaptanib
(MACUGEN), erhöhen die Chance auf Erhalt des Sehvermögens. Verbesserung des Visus ist nicht zu erwarten.
 Die besten Ergebnisse werden mit dem ab Mitte Februar erhältlichen
intravitreal angewendeten VEGF-Hemmer (Ranibizumab (LUCENTIS) erzielt: Bei etwa einem Drittel der Patienten ist eine Verbesserung des Visus beschrieben. Die
Kosten für das Mittel sind mit 18.000 (/Jahr sehr hoch. Aktuell warnt der Hersteller vor erhöhtem Schlaganfallrisiko unter Ranibizumab. Die besten Ergebnisse werden mit dem ab Mitte Februar erhältlichen
intravitreal angewendeten VEGF-Hemmer (Ranibizumab (LUCENTIS) erzielt: Bei etwa einem Drittel der Patienten ist eine Verbesserung des Visus beschrieben. Die
Kosten für das Mittel sind mit 18.000 (/Jahr sehr hoch. Aktuell warnt der Hersteller vor erhöhtem Schlaganfallrisiko unter Ranibizumab.
 Für den Gebrauch des nur in der Krebstherapie zugelassenen VEGF-
Hemmers Für den Gebrauch des nur in der Krebstherapie zugelassenen VEGF-
Hemmers  Bevacizumab (AVASTIN) liegen bei Makuladegeneration lediglich Fallserien
vor, die eine Beurteilung von Wirksamkeit und Störwirkungen nicht ermöglichen. Die Durchführung einer klärenden randomisierten Studie im
Vergleich zu Ranibizumab ist dringend erforderlich. Bevacizumab (AVASTIN) liegen bei Makuladegeneration lediglich Fallserien
vor, die eine Beurteilung von Wirksamkeit und Störwirkungen nicht ermöglichen. Die Durchführung einer klärenden randomisierten Studie im
Vergleich zu Ranibizumab ist dringend erforderlich.
|
| |
|
| | | (R = randomisierte Studie, M =
Metaanalyse)
|
| | 2 | SINGERMAN, L.J. et al.:
Retina 2005; 25 (7 Suppl.): S1-S22 |
| | 4 | FINE, S.L. et al.: N. Engl. J. Med. 2000;
342: 483-92 |
| | 17 | Van LEEUWEN, R. et al.: JAMA 2005;
294: 3101-7
|
R | 19 | Complications of Age-Related Macular Degeneration Prevention Trial Research Group:
Ophthalmology 2006; 113: 1974-86 |
R | 22 | Age-Related Eye
Disease Study Research Group: Arch. Ophthalmol. 2001; 119: 1417-36 |
R | 23 | Age-Related Eye
Disease Study Research Group: Control. Clin. Trials 1999; 20: 573-600 |
R | 29 | Macular Photocoag.
Study Group: Arch. Ophthalmol. 1991; 109: 1109-14 |
R | 30 | Macular Photocoag.
Study Group: Arch. Ophthalmol. 1994; 112: 500-9 |
R | 31 | Macular Photocoag.
Study Group: Arch. Ophthalmol. 1993; 111: 1200-9 |
R | 32 | Macular Photocoag.
Study Group: Arch. Ophthalmol. 1994; 112: 489-499 |
| | 33 | Novartis Pharma: Fachinformation
VISUDYNE, Stand Juli 2005 |
| | 34 | Gemeinsamer Bundesausschuss:
http://www.g-ba.de/cms/upload/pdf/abs5/beschluesse/2006-02-
21-PDT-Gruende.pdf
|
R | 35 | TAP Study Group: Arch.
Ophthalmol. 1999; 117: 1329-45 |
R | 36 | TAP Study Group: Arch.
Ophthalmol. 2001; 119: 198-207 |
R | 37 | VIM Study Group: Arch.
Ophthalmol. 2005; 123: 448-57 |
R | 38 | VIP Study Group: Am. J.
Ophthalmol. 2001; 131: 541-60 |
R | 39 | TAP Study Group: Arch.
Ophthalmol. 2002; 120: 1307-14 |
| | 40 | KAISER, P.K.: Graefe's Arch. Clin. Exp.
Ophthalmol. 2006; 244: 1132-42 |
| | 41 | ESSEX, R.W. et al.: Clin. Experiment.
Ophthalmol. 2003; 31: 476-81 |
R | 42 | GRAGOUDAS. E.S. et
al.: N. Engl. J. Med. 2004; 351: 2805-16 |
R | 43 | V.I.S.I.O.N Clinical Trial
Group: Ophthalmology 2006; 113: 1508-21 |
| | 44 | Novartis Pharma:
http://www.novartis.ch/files/lucentis-20060829.pdf |
| | 45 | Novartis Pharma: Schreiben vom 25. Jan.
2007 |
R | 46 | ROSENFELD, P.J. et
al.: N. Engl. J. Med. 2006; 355: 1419-31 |
R | 47 | BROWN, D.M. et al.: N.
Engl. J. Med. 2006; 355: 1432-44 |
| | 48 | FDA: LUCENTIS, Approved Labeling;
http://www.fda.gov/cder/foi/nda/2006/125156s0000_lucentis_Prntlbl.pdf
|
R | 49 | FDA:
LUCENTIS, Medical Review;
http://www.fda.gov/cder/foi/nda/2006/125156s0000_lucentis_MedR.pdf
|
R | 50 | HEIER, J.S. et al.: Arch.
Ophthalmol. 2006; 124: 1532-42 |
| | 51 | GILLIES, M.C.: Arch. Ophthalmol. 2006;
124: 1478-9 |
| | 52 | AVERY, R.L. et al.: Ophthalmology 2006;
113: 363-72 |
| | 53 | ITURRALDE, D. et al.: Retina 2006; 26:
279-84 |
| | 54 | SPAIDE, R.F. et al.: Retina 2006; 26:
383-90 |
| | 55 | BASHSHUR, Z.F. et al.: Am. J.
Ophthalmol. 2006; 142: 1-9 |
| | 56 | Urteil des Bundesgerichtshofs vom 13.
Juni 2006; AZ VI ZR 323/04;
zu finden unter:
http://www.bundesgerichtshof.de
|
| | 57 | National Eye Institute: Stellungnahme vom
Nov. 2006
http://www.nei.nih.gov/news/statements/amd_therapy.asp
|
R | 58 | ARIAS, L. et al.:
Ophthalmology 2006; 113: 2243-50 |
| | 59 | PENFOLD, P.L. et al.: Aust. N. Z. J.
Ophthalmol. 1995; 23: 293-8 |
R | 60 | GILLIES, M.C. et al.:
Arch. Ophthalmol. 2003; 121: 667-73 |
R | 61 | GILLIES, M.C. et al.:
Arch. Ophthalmol. 2004; 122: 336-40 |
| | 62 | BAKRI, S.J., KAISER, P.K.: Expert Opin.
Investig. Drugs 2006; 15: 163-9 |
| | 63 | EMEA: Pressemitteilung vom 2. März
2006
http://www.emea.eu.int/humandocs/PDFs/EPAR/retaane/7694506en.pdf
|
R | 64 | SIVAGNANAVEL, V. et al.: Radiotherapy for neovascular age-related macular degeneration; The Cochrane Database of Systematic Reviews 2007,
Issue 1; Stand Mai 2004 |
| | 65 | NICE: Radiotherapy for age-related
macular degeneration; März 2004
http://www.nice.org.uk/page.aspx?0=IPG049guidance
|
R | 66 | Pharmacological
Therapy for Macular Degeneration Study Group: Arch. Ophthalmol. 1997; 115: 865-72 |
R | 67 | MYINT, K. et al.: Acta
Ophthalmol. Scand. 2006; 84: 328-32 |
R | 68 | GUSTAVSSON, C. et
al.: Acta Ophthalmol. Scand. 2005; 83: 148-53 |
| | 69 | GROVES, N.: Ophthalmology Times vom
1. Juni 2005;
http://www.ophthalmologytimes.com/ophthalmologytimes/article/articleDetail.jsp?id=165507 |
| | 70 | Genentech: Dear Healthcare Provider
Letter vom 24. Jan. 2007;
http://www.gene.com/gene/products/information/pdf/healthcare-provider-letter.pdf |
| © 2007 arznei-telegramm |